酸化と還元
酸化と還元について説明をしたいのですが、基礎物理と基礎化学科目最後のあたりに出題される問題は、「pH指示薬」「酸と塩基の性質」「酸化と還元の反応」などから出題され、何となく出題が安定していません。どういった問題が出るかというのが大変あやふやです。
何でもかんでも暗記出来る方はさておき、そうではない方が当サイトを多く利用されていると仮定すると、ポイントを絞り込んで差し上げなければならないと考えます。
深く突っ込んだ内容は避けて、過去の出題に沿った内容を記載してゆきますので、散文的になりがちですが、呪文とでも思って暗記に徹してください。
酸と塩基
何となく「酸」と「アルカリ」という言葉は聞いたことがあるでしょう。
「酸性雨」「アルカリ還元水」等々。
これを狭義の意味で化学的説明をすると次のようになります。
酸
水に溶けると電離して水素イオンH+を生ずる物質、または他の物質に水素イオンH+を与えることの出来る物質。
なんだか難しいでしょ?「H+」というのを覚えておいてください。
代表的な物質
- 塩酸
- 硝酸
- 酢酸
塩基
水に溶けると電離して水酸化物イオンOH-を生ずる物質、または他の物質に水素イオンH+を受け取ることの出来る物質。
「OH-」というのを覚えておいてください。
代表的な物質
- 水酸化ナトリウム
- 水酸化カリウム
- アンモニア
ph
酸や塩基を調べるのにはpH指示薬を用います。小学校の時にはリトマス試験紙やリトマス液を使ったと思いますが、これもpH指示薬の一種です。
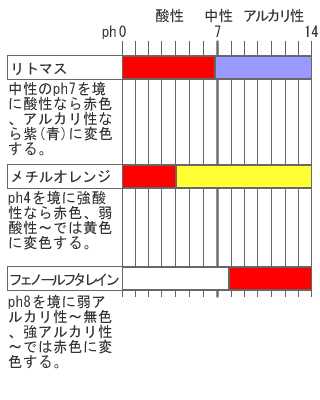
本家サイトにはもう少し詳しく掲載しています。ただ、これを覚えようと躍起になるのはあまり効率の良い学習方法ではありません。余裕のある方だけ覚えるようにしてください。
中和
酸と塩基を混ぜると塩と水ができます。
この反応のことを中和反応または、中和と言います。
例えば、HCl(塩酸)とNaOH(水酸化ナトリウム)を混ぜると、塩化ナトリウムと水ができます。これが中和です。
ただし、この水溶液を完全に中和するには、同じグラム当量でなければなりません。
この辺はあまり深く考えずに、そんなものだと思っていてください。
酸化と還元
物質が酸素と結合することを酸化と言い、酸化物が酸素を失うことを還元と言います。
つまり、炭が燃えて二酸化炭素になる場合、炭(炭素)と酸素が結びつくので酸化ですが、酸素と炭(炭素)が結びつくのは還元されたということが出来ます。酸素そのものが還元されるとはちょっとおかしな話ですが、そういうものとして覚えてください。
そして、酸化と還元は一つの反応で同時に起こるものだと言うことも覚えてください。