物質の状態変化
物理・化学科目の後半部分になると、物理・化学の基礎知識が問われる問題が出題されます。
この基礎知識を全て間違うと不合格になりますので、基礎物理と基礎化学でカットして良い学習項目は計算問題だけです。
そう聞くと、ちょっと安心出来たと思いますが、学習をカットするというのは、まるっきり学習しないと言うことではありません。
変に頭を悩ますのならば、そこそこにして先に進むという意味です。もしかしたら練習問題などで解いた問題の数値が、そのまま出題される可能性もあるのですから、必ずちょっとは勉強してください。
物質の三態
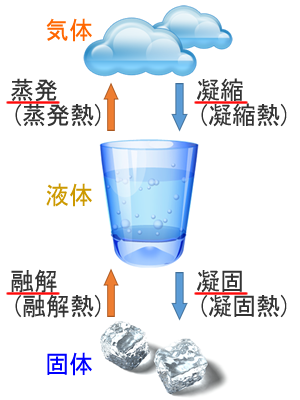
上記図の通りです。固体、液体、気体の3つの形態があります。
物質の中には、常圧では液体の状態がない物質もあり、その物質が固体から気体、気体から固体に直接変化することを「昇華」と言います。
気体とは液体を通常状態としたときと比較すると分子が激しく運動している状態です。
固体は分子の動きが緩慢で、その運動が限りなく停止するのは-273.15℃。古典物理学ではこれを絶対0℃と呼んで、全ての分子運動が停止するとしていましたが、量子力学ではそうではないことが分かっています。
絶対0℃という言葉が出てくると思い出してしまいます。
セ●ント●矢 キグ●ス・・・。
見たことがない人には、まったく訳が分からなくてごめんなさい。
ちょっとした息抜きです。
気体と液体間の変化
蒸発
蒸発とは液体の表面から気化が起こる現象です。これは固体の表面からも起こりますが、その場合は昇華と言います。
それでは沸騰とはどう違うのでしょうか?
沸騰は液体を加熱した際に、液体の表面だけではなく内部からも蒸発が起こる現象です。そして、この沸騰状態となる液温のことを「沸点」といいます。
単に蒸発が始まる液温は、特別な言い方はありませんが、引火性液体の場合だと可燃性ガスが発生し始めるので、引火点がそれに該当します。
沸点について
沸点は、外圧に影響を受けます。
高い山の山頂などでは気圧は低くなります。そういった場所でお湯を沸かそうとすると100℃にならなくても沸騰が始まります。
逆に、気圧が高ければ沸点も高くなります。これを利用しているのが圧力釜です。
圧力釜の中は気圧が高くなるので、水の沸点が120℃とかになったりします。そのため、食材に早く火が通り、調理時間が早くすむと共に、圧縮して浸透した水分などが膨張するために食材が柔らかくなったりします。
試験に必要な知識は、「外圧が高くなれば沸点も高くなり、外圧が低くなれば沸点も低くなる」という部分です。
前記のことは、液体の飽和蒸気圧と外圧の関係を言い換えています。つまり、液体を熱してゆくと、気体になろうとしますが、外圧よりも蒸気になろうとする圧力が低いうちは沸騰しません。この力関係が均衡する温度が沸点なのです。沸点では液体と気体が同時に存在し、液体はそれ以上の液温となることはできません。ここからは気体となるしかありません。
「飽和蒸気圧と外圧が等しくなったときの液温を沸点という」こんな文章も覚えておきましょう。

基礎用語の説明
液比重
1気圧における銅体積で4℃の純粋な水を1として比較した場合の数値
例えば、ガソリンの液比重は約0.7ですから、水にガソリンを注ぐと表面に浮きます。
また、エタノールの液比重は0.8ですから、これも表面に浮きます。。
密度
物質の体積あたりの質量です。
単位は、「g/c㎡」です。
密度(g/c㎡)=
物質の質量(g)÷物質の体積(c㎡)
蒸気比重
同温で同圧下において同体積の空気と比較した値。
ちなみに、第4類の引火性危険物の可燃性蒸気は、全て空気よりも重いです。
潮解・風解
潮解とは固体の物質が空気中の水分を吸って、湿って溶解する現象をいいます。
風解とは結晶水を含んだ物質を空気中に放置しておくことで自然に結晶水の一部または全部を失う現象をいいます。
どちらもそういった現象があることを覚えておいてください。引っかけとして選択肢で登場します。
状態変化とは関係がありませんので要注意です。